細胞の「力」を測って再生医療の質を高める 〜軟骨細胞の脱分化メカニズム解明から始まる、 新たな細胞品質評価法の確立〜
システムデザイン研究科機械システム工学域の山崎雅史助教は、細胞が発生する物理的な力を測定する独自の技術を用いて、再生医療における細胞の品質評価法の確立を目指しています。特に軟骨細胞の脱分化メカニズムの解明を通じて、高品質な再生医療用細胞の培養法開発に取り組んでいます。

山崎 雅史 助教
YAMAZAKI Masashi
システムデザイン研究科 機械システム工学域
1992 年長野県上田市生まれ。2021 年東京都立大学大学院システムデザイン研究科機械システム工学域にて博士号(工学)取得。同年、民間企業にて再生医療関連の研究開発職に従事した後、2023 年東京都立大学大学院システムデザイン研究科機械システム工学域にて助教を務め、現在に至る。
なぜ再生医療の研究を始めたのか
【Web限定】私が研究者として歩み始めたきっかけは、高校時代に見た父親の姿でした。1992年に長野県上田市で生まれた私は、高校時代はサッカーに夢中でしたが、進路を考えるというタイミングで、父がうつ病を患ってしまったのです。50歳という働き盛りの頃で、プラスチック成型機を製造する会社に長年勤めていた父が、突然働けなくなってしまった──。当時は就職氷河期の真っ只中で、就職は厳しいという話をよく聞かされていました。そんな状況で父の姿を見て、私は「いつ何が起こるか分からない。後悔しないよう情熱を持って働ける仕事に就かなければ」と強く思いました。
私は子どもの頃からとても怖がりで、特に人にどう思われているかをいつも気にするような性格でした。周囲の評価を気にして、自分らしさを見失いがちだったのです。しかし、父の病を機に、「就職してどこに勤めるか」ではなく「就職して何をするか」を重視して進路を選ぶことにしたのです。浪人時代、私は医学部コースで学んでいました。一緒に勉強していた仲間たちは皆、医師を目指していましたが、私自身は専門性が高まるにつれ、「繊細な手術は私には無理かもしれない」と感じ始めていました。それでも、医療に貢献できる仕事には強く惹かれていました。そんな時に出会ったのが再生医療の研究だったのです。
自分の体から細胞を取り、その細胞をもとに治療するという再生医療のアプローチを知った時、とても理にかなっていると直感しました。外来物質による感染リスクを避けられ、自分の細胞なので体に馴染みやすい。培養環境を適切にコントロールできれば回復力も調整できるからです。
東京都立大学の藤井先生の研究室を知ったのは、インターネットで再生医療の研究を検索していた時のことです。ちょうどiPhoneが普及し始めた頃で、各大学のホームページも充実してきていましたが、医療に関する研究をしている研究室は意外と少なく、その中で藤井先生の研究室が最有力候補として浮上したのです。学部から博士課程まで研究を続けた後、私は一度企業に就職しました。コラーゲン製品を扱う会社の研究開発職として2年間働いたのですが、この経験が後の研究人生に大きな影響を与えることになりました。
企業では「企業理念に基づいた明確なゴール」に向かって研究を進めます。企業理念にどれだけ自分の価値観がマッチしているかが、研究のモチベーションや成果に直結するのです。一方、大学では「個人の好奇心に基づいた自由度の高い研究」ができます。制約は少ないものの、自分で研究の方向性を決め、その意義を発信していく責任があります。両方の経験があったからこそ、今の研究に対する多角的な視点が形成されたと思います。
メカノバイオロジーで細胞の謎に迫る
現在私が取り組んでいるのは、「幹細胞の分化に対するメカノバイオロジー的研究」と「生体軟組織修復を目的とした再生材料の開発」です。メカノバイオロジーとは、細胞が周囲の物理的環境(硬さ、流れ、圧縮・伸展など)をどのように感知し、それを生理的な応答に変換するかを探求する比較的新しい学問分野です。幹細胞は培養皿の底にくっついて生きていくのですが、その際に培養皿の硬さを感知して、骨になるか軟骨になるか、それとも他の柔らかい組織の細胞になるかを「細胞自身が自分で決める」ことができるのです。では、細胞はどのようにしてこの物理的環境を感知しているのか?この純粋な疑問こそが、私の研究の出発点です。
再生医療にとって軟骨細胞は重要な研究テーマですが、ある大きな課題に直面 しています。軟骨細胞は体外で培養すると「脱分化」という現象を起こし、本来の軟骨らしい性質を失ってしまうのです。軟骨は本来、コラーゲンやプロテオグリカンといった水分保持に必要なタンパク質を分泌して、関節の潤滑や衝撃吸収という重要な機能を維持しています。ところが、体外で培養するとこれらの分泌を停止してしまい、硬い繊維状の組織に変化してしまうのです。そこで私は、ある仮説を立てました。細胞の骨格構造(アクチン細胞骨格)が硬い培養環境で発達し、それが細胞核に物理的な力を伝達することで脱分化が引き起こされるのではないか、と。この仮説を検証するため、私は細胞内で発生する力を蛍光タンパク質を用いて可視化・定量化する技術を開発しました。実際に、脱分化が進む軟骨細胞では、細胞核への張力が明らかに増加していることが観察されています。

精密な機器を使って細胞の生育状態の三次元的なデータを取得
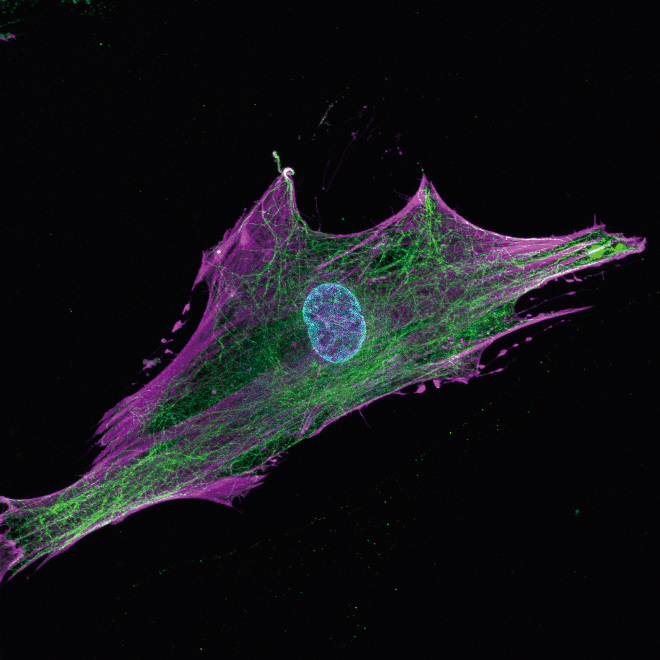
青色はDNA(細胞の核)、紫色と緑色は細胞骨格を示す。幹細胞はこの細胞骨格を通じて培養皿の硬さを感じ取る
従来技術を超える新たなアプローチ
従来の細胞品質評価法は、特定のマーカータンパク質の有無を調べるオン・オフ式の判定が主流でした。しかし、この方法では判別できない細胞が多数存在し、特に質の悪い細胞が増殖しやすいという問題がありました。これに対して、私が開発している力測定技術の優位性は、細胞の「動的な状態」を連続的に評価できる点にあります。細胞が培養基板を引っ張る力や、細胞骨格から核に伝わる張力を3次元で測定することで、従来の静的なマーカー評価では捉えられない細胞の微細な変化を検出できるのです。
さらに重要なのは、この技術では蛍光顕微鏡を用いて客観的な数値データを取得できることです。従来の方法では評価者の主観が入りやすく、職人的な判断に依存する部分がありました。しかし、力測定技術では光の強度変化を数値化するため、標準化された客観的な評価が可能になります。現在の研究では、脱分化の進行と細胞核への力の増加との間に明確な相関関係が観察されており、新しい品質評価指標としての確立が現実味を帯びてきています。
幅広い分野での技術活用を目指して
この技術の応用範囲は広いと考えています。まず直接的には、軟骨再生医療における細胞の品質管理です。変形性膝関節症の患者さんは国内だけでも数百万人おり、高齢化に伴ってその数は増加の一途をたどっています。また、スポーツ外傷による軟骨損傷も深刻な問題です。高品質な軟骨細胞を安定して供給できれば、これらの患者さんの治療効果を大幅に改善できる可能性があります。応用はそれだけにとどまりません。幹細胞を用いた様々な再生医療において、細胞の分化状態や品質を力学的指標で評価することで、より精密な細胞製品の品質管理が可能になります。その結果、血管を構成する細胞など、様々な細胞種に応用できる可能性があります。
特に期待しているのは、個別化医療の実現への貢献です。患者さん一人ひとりから採取した細胞を最適な状態に調整して治療に用いる際、力測定技術により、より精密な品質保証が可能になれば、「誰もが高品質な個別化医療を受けられる社会」の実現に近づくことができるでしょう。長期的には、この技術が高齢化社会における「アクティブエイジング」の実現に寄与することを強く願っています。日本は世界に先駆けて超高齢社会を迎えていますが、「高齢者が元気に活躍し続ける社会」のモデルを世界に示したいと考えています。
産学連携への期待
今後3年程度で、細胞の力学的状態と品質との相関関係を明確に証明し、新しい評価指標として確立することを目標としています。実用化に向けては、製造プロセスの安定化と効率化が重要な課題です。現在、細胞培養に使用する基材は研究室で一から作製しており、非常に長い工程を経ています。そこで特に期待しているのが、微細加工技術を持つ企業との連携です。細胞は数十マイクロメートルという非常に小さな世界で生きており、その環境を制御するためには1桁マイクロメートルレベルの精密な構造制御が必要になります。ガラスやプラスチック材料の精密加工技術を持つ企業との協力により、安定した基材の供給が可能になれば、研究は大きく加速するでしょう。
意外かもしれませんが、食品メーカーとの連携にも可能性を感じています。食品製造における材料処理技術や品質管理システムは、細胞培養にも応用できる部分があるのではないかと考えているからです。また、計測工程の自動化・効率化も重要な課題であり、オートメーション技術を持つ企業との協力も期待しています。
そうした企業の力も借りて、私の研究が最終的には誰もが高品質な個別化医療を受けられる社会の実現に貢献できることを心から願っています。そして、日本が世界に先駆けて、高齢化社会でも皆が元気に活躍できる「最強のエイジング社会」のモデルを示していけたら…それが私の研究者としての最大の目標です。



